Харитонова Н.Л. (ФБУ «НТЦ ЯРБ», Москва, Россия), Гурбанова Ш.А. (НИЯУ МИФИ, Москва, Россия)
Введение
Реализация мероприятий по увеличению выработки электроэнергии на энергоблоках АЭС с ВВЭР, предусматривающая в качестве одного из направлений увеличение межремонтного цикла энергоблоков до 18 месяцев, а также мероприятия по увеличению единичной мощности энергоблоков (проекты ВВЭР-1200/ВВЭР-ТОИ) показало, что данные по растворимости соединений борной кислоты в водном теплоносителе необходимы для расчетного моделирования с целью выработки технологических решений, обеспечивающих обоснованное отсутствие кристаллизации соединений борной кислоты [1].
Увеличение продолжительности топливных циклов определяет необходимость компенсации увеличенного запаса реактивности на выгорание, т.е. приводит к повышению концентрации жидкого поглотителя (борной кислоты) в теплоносителе в начале компании. С другой стороны, следствием повышения начальной концентрации борной кислоты, увеличения продолжительности топливного цикла и тепловой мощности активной зоны становится рост в теплоносителе концентрации лития, нарабатываемого в ходе топливной кампании из борной кислоты по реакции 10B (n, ?) 7Li [1].
С целью понимания механизма, по которому соединения борной кислоты могут осаждаться в активной зоне, а также для прогнозирования количества и условий кристаллизации этих соединений, необходимо знание закономерностей концентрирования этих соединений.
Условием образования твердой фазы любого труднорастворимого электролита, в том числе, склонных к кристаллизации соединений борной кислоты, является достижение произведения активностей ионов в растворе величины произведения растворимости соответствующего соединения при данной температуре.
Для РУ ВВЭР принят слабощелочной восстановительный координированный водородно-калиевый водно-химический режим с борной кислотой [2]. Состав теплоносителя первого контура, определяется, в первую очередь, присутствием соединений борной кислоты и щелочных металлов (калия, натрия, лития). Минимально допустимые значения концентрации борной кислоты в теплоносителе, в воде бассейна выдержки и в баках борированных растворов систем безопасности реакторной установки установлены исходя из обеспечения необходимого уровня подкритичности реактора во всех режимах эксплуатации энергоблока.
Увеличение продолжительности топливных циклов в проектах ВВЭР-ТОИ определяет необходимость компенсации увеличенного запаса реактивности на выгорание, т.е. приводит к повышению концентрации борной кислоты в теплоносителе и в емкостях системы безопасности (в емкостях системы пассивного залива активной зоны, в баках хранения борного раствора системы и пр.) [2]. Например, в состоянии энергоблока «перегрузка топлива» и «останов для ремонта» контрольный уровень для концентрация борной кислоты в теплоносителе увеличивается до 17–25 г/дм3, тогда как для энергоблоков ВВЭР-1000 проекта РУ В-320 диапазон концентраций борной кислоты составляет 16–20 г/дм3.
Рост концентрации борной кислоты определяет увеличение концентраций ионов калия (гидроксид калия дозируется для нейтрализации борной кислоты), ионов лития (нарабатывается по реакции 10B (n, ?) 7Li.). Увеличение исходных концентраций, как самой борной кислоты, так и ее соединений (боратов калия, лития и натрия) повышает риск кристаллизации соединений борной кислоты в активной зоне реактора.
Риск кристаллизации соединений борной кислоты в реакторе определяется достижением предельной концентрации, которая зависит от растворимости равновесной формы существования соединений борной кислоты в растворе.
Возможность образования кристаллизации соединений борной кислоты в активной зоне реактора зависит от химического состава этих соединений при конкретных параметрах теплоносителя и определяется достижением концентраций (термодинамических активностей), превышающих при том или ином сочетании параметров предел растворимости.
С целью оценки возможных рисков кристаллизации соединений борной кислоты в активной зоне на энергоблоках ВВЭР-1200 в данной работе выполнены систематизация и оценка имеющихся литературных данных по растворимости соединений борной кислоты.
В докладе представлены результаты систематизации имеющихся в литературе данных по растворимости борной кислоты и ее соединений (боратов калия и лития) в водных растворах в диапазоне температур до 350 °C и давлений до 17 МПа.
На основании собранных экспериментальных данных получены аппроксимирующие функции растворимости соединений борной кислоты в водных растворах в зависимости от температуры. Выполнена оценка погрешности проведенной аппроксимации.
1. Формы существования соединений борной кислоты в теплоносителе
Диссоциация борной кислоты в теплоносителе происходит с образованием полиборатных комплексов типа В(ОН)3о, В(ОН)4–, В3(ОН)10–, В2(ОН)7–, В4(ОН)142–, образующихся в соответствии с уравнениями химических реакций [3,4]:
х·[В(ОН)3]о + y·[ОН–] = Вx(ОН)3x+yy-.
Химия водных растворов борной кислоты сложна вследствие образования различных гидратированных форм – полиборатов, высокой летучести борной кислоты и присутствия в системе значительного количества нейтральных молекул. Распределение форм существования соединений борной кислоты в растворе, в свою очередь, зависит от температуры, от рН, ионной силы раствора и пр. В кислых средах (рН25<6) присутствуют, преимущественно нейтральные молекулы В(ОН)3о и анионы типа Вn(ОН)10-, а в щелочных растворах (рН25> 10) преобладают полиборатные комплексы типа В3(ОН)10–; В4(ОН)142– (см. рис.1) [4,5].
Присутствие в растворе перечисленных полиборатных соединений подтверждено результатами экспериментальных исследований (потенциометрическое титрование, инфракрасный и ионообменный анализ, ЯМР-спектроскопия, рамановская спектроскопии) (рис. 1) [6].
2. Растворимость борной кислоты в водном растворе при повышенных температурах
Равновесными твердыми фазами существования борной кислоты в системе «борная кислота – вода» при повышенных температурах являются: ортоборная кислота (Н3ВО3кр), три монотропных модификации НВО2кр (метаборная кислота) и В2О3кр (ангидрид борной кислоты) [7,8].
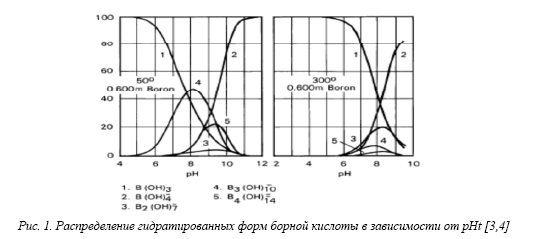
Рис. 1. Распределение гидратированных форм борной кислоты в зависимости от рНt [3,4]
Равновесная форма существования твердой фазы борной кислоты зависит от температуры.
Ортоборная кислота (Н3ВО3кр) может существовать в области температур вплоть до температуры, равной 171 °C [7,9] (170 °C [8,10], 181 °C [11]), при которой наблюдается ее конгруэнтное плавление.
В области температур от 171 до 201 °C [7,9] (203 °C [8, 10]) возможно существование метаборной кислоты (НВО2кр). При температурах свыше 201 °C формой существование является В2О3кр.
Ортоборная кислота Н3ВО3кр при плавлении образует метаборную кислоту НВО2кр, существующую в трех кристаллических формах (НВО2крI, НВО2крII и НВО2крIII). При дальнейшем нагревании и плавлении НВО2кр образуется оксид бора В2О3кр.
Температуры плавления НВО2крI, НВО2крII и НВО2крIII составляют 236, 201 и 176 °C соответственно [7].
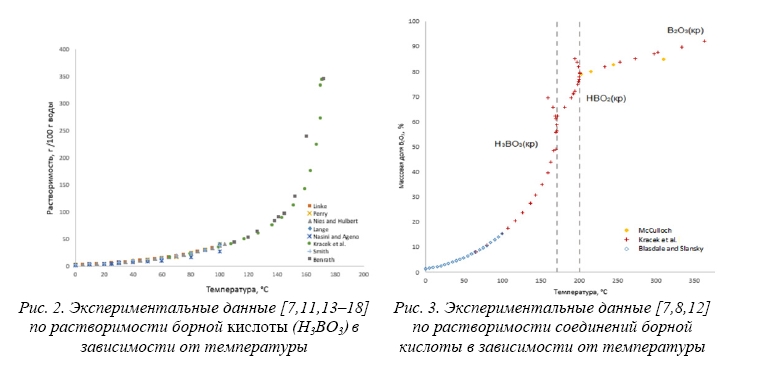
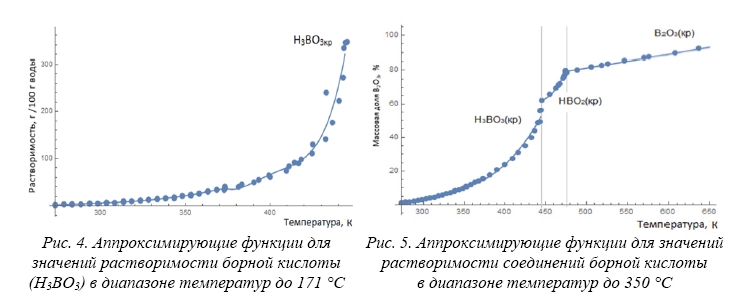
В результате обработки и систематизации экспериментальных данных [7, 8, 11–18] в данной работе построены зависимости растворимости перечисленных выше равновесных форм существования твердых фаз борной кислоты в системе Н3ВО3/НВО2/В2О3 – H2O от температуры (рис. 2 и 3). На рисунке 3 указана растворимость в массовых долях B2O3 по рекомендации IUPAC [19].
Как следует из рисунка 2, полученные разными авторами данные по растворимости ортоборной кислоты при температурах ниже температуры 171 °C, согласуются между собой. Исключение представляют результаты работы [14], в которой полученные при температурах раствора ниже 100 °C значения растворимости ортоборной кислоты занижены по сравнению с экспериментальными результатами работ [7, 8, 11–13, 15–18]. Данные о растворимости ангидрида борной кислоты при температурах выше 201 °C приведены в исследованиях Kracek et al. [7] и McCulloch [8], в которых растворимость В2О3кр определена вплоть до температуры плавления (около 450–470 °С).
Результаты экспериментального определения растворимости соединений борной кислоты (концентраций) приводятся в проанализированных работах [7, 8, 11–18] в различных единицах измерения концентрации: как в безразмерных (мольные доли, проценты), так и в размерных величинах (молярность, моляльность, граммы на литр раствора, граммы на литр растворителя).
Для сравнения и оценки достоверности экспериментальных данных по растворимости соединений борной кислоты, полученных авторами в разных экспериментах, значения концентраций были пересчитаны с целью приведения к одним и тем же единицам измерения концентрации.
Пересчет концентраций из массовой доли wt и мольной доли в моляльность m выполнятся по формулам (1) и (2): 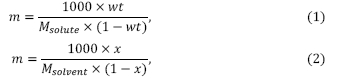 где wt – массовая доля растворенного вещества, х – мольная доля растворенного вещества в растворе, – молярная масса растворенного вещества, г/моль, Мsolute – молярная масса растворенного вещества, Мsolvent – молярная масса растворителя, г/моль.
где wt – массовая доля растворенного вещества, х – мольная доля растворенного вещества в растворе, – молярная масса растворенного вещества, г/моль, Мsolute – молярная масса растворенного вещества, Мsolvent – молярная масса растворителя, г/моль.
Аппроксимирующие уравнения для расчета растворимости устойчивых фаз борной кислоты в зависимости от температуры имеют вид:
![]()
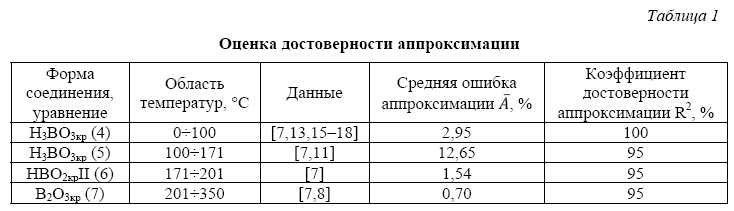
Для аппроксимации экспериментальных данных использовался программный пакет Wolfram Mathematica. Применяемый тип аппроксимации – регрессия. Для решения задач регрессии использовалась функция Fit: Fit[data, funs, vars], которая ищет приближение для списка данных Data методом наименьших квадратов. В данной работе использована полиномиальная регрессия. Полученные аппроксимирующие функции для трех фазовых областей раствора борной кислоты представлены на рисунках 4 и 5.
Зависимость растворимости ортоборной кислоты (Н3ВО3кр) в водном растворе от температуры, полученная аппроксимацией экспериментальных данных [7,13,15–18], описывается аппроксимационным выражением:
![]()
которое справедливо в диапазоне температур 273,15 / 373,15 K.
Зависимость растворимости ортоборной кислоты (Н3ВО3кр) в водном растворе от температуры, полученная аппроксимацией экспериментальных данных [7,11], описывается аппроксимационным выражением:
![]()
которое справедливо в диапазоне температур 373,15 / 444,15 K.
Зависимость растворимости метаборной кислоты (НВО2крII) в водном растворе от температуры, полученная аппроксимацией экспериментальных данных [7], описывается аппроксимационным выражением:
![]()
справедливым в диапазоне температур 444,15 / 476,15 K.
Зависимость растворимости оксида бора ( В2О3кр) в водном растворе от температуры, полученная аппроксимацией экспериментальных данных [7,8], описывается аппроксимационным выражением:
![]()
справедливым в диапазоне температур 476,15 / 623,15 K.
Растворимость, рассчитанная по уравнениям (4) – (5), измеряется в граммах на 100 грамм воды. В уравнениях (6) – (7) растворимость определена в массовых долях B2O3 по рекомендации IUPAC [19].
На рисунке 6 приведено сравнение принятых для анализа экспериментальных mэ и расчетных mр значений растворимости борной кислоты (получены по приведенным выше аппроксимирующим зависимостям). Как следует из рисунка 6, точки, полученные экспериментально, располагаются около линии m э/mр = 1 с разбросом ± 15 %.
Для оценки погрешности аппроксимирующих функций были рассчитаны значения средней ошибки аппроксимации и коэффициента достоверности аппроксимации R2 (табл.1):

где mэ – экспериментальное значение, mp – расчетное значение, N – количество использованных в аппроксимации точек, – среднее значение набора экспериментальных данных.
Из данных таблицы 1 следует, что для полученных аппроксимирующих функций в данной работе средняя ошибка аппроксимации не превышает 13 %, а коэффициент достоверности аппроксимации составляет не менее 95 %.
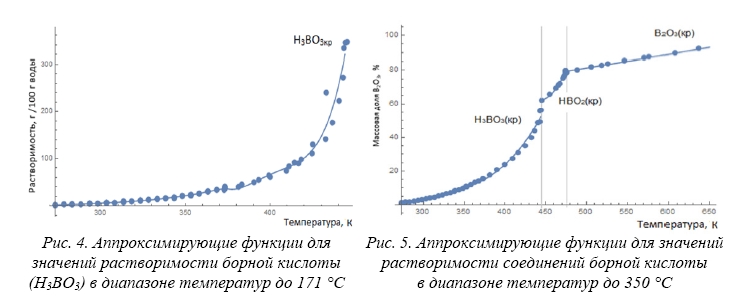
Таблица 1
Оценка достоверности аппроксимации
3. Растворимость боратов щелочных металлов в водном растворе при повышенных температурах
Щелочные металлы в зависимости от условий образуют с борной кислотой метабораты BO•H O, тетрабораты BO•H O, пентабораты BO•H O и иные полиборатные соединения.
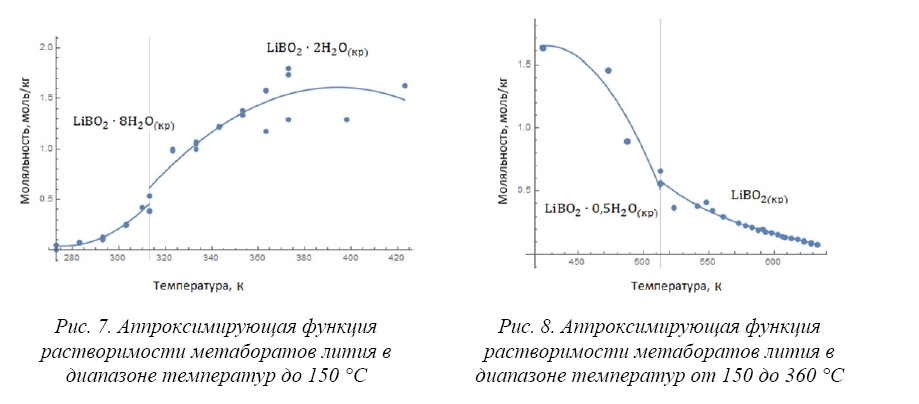
Равновесными твердыми фазами существования боратов лития в системе «борная кислота – гидроксид лития – вода» в диапазоне температур 0– 350 °С являются: метабораты лития LiBO•8H O(кр), LiBO•2H O(кр), LiBO•0,5HO(кр), LiBO (кр), тетраборат лития LiBO•3H O(кр) и пентабораты лития LiB O•5H O(кр), LiBO•0,5HO(кр) [9,15,20–23].
В условиях теплоносителя первого контура реакторных установок с PWR при температурах насыщения свыше 300 °C наиболее вероятной равновесной формой существования твердой фазы в системе «борная кислота — гидроксид лития» является метаборат лития LiBO(кр) [24]. Из всех солей борной кислоты это соединение имеет минимальную растворимость и характеризуется отрицательным коэффициентом растворимости (т.е. растворимость метабората лития падает с ростом температуры).
Равновесная форма существования твердых фаз боратов лития зависит от температуры.
При образовании метаборатов лития в системе «борная кислота – гидроксид лития – вода» кристаллогидрат LiBO•8H O(кр) может существовать в области температур вплоть до температуры, равной 40 °С, выше которой возможно наличие кристаллогидрата LiBO•2H O(кр) при температурах, не превышающих 150 °С [9, 15, 20]. Согласно [9] в области температур от 150 до 240 °С может присутствовать кристаллогидрат LiBO•0,5HO(кр). Присутствие кристаллов метабората лития LiBO(кр) при температурах свыше 240 °С установлено в работах [9,21–23]. Данные о растворимости метаборатов лития в водном растворе определены вплоть до температуры, равной 360 °С [21].
При образовании тетрабората лития в системе «борная кислота – гидроксид лития – вода» кристаллогидрат LiBO•3H O(кр) может существовать в области температур до 100 °С [9]. Данные о присутствии кристаллогидрата LiBO•3H O(кр) при повышенных температурах отсутствуют. При образовании пентаборатов лития в системе «борная кислота – гидроксид лития – вода» кристаллогидрат LiBO•5H O(кр) может существовать в области температур вплоть до температуры, равной 130 °С, выше которой возможно наличие кристаллогидрата LiBO•0,5H O(кр). Данные о растворимости пентабората лития LiB O•0,5H O(кр) в водном растворе определены вплоть до температуры, равной 300 ° С [9].
Зависимость растворимости кристаллогидрата метабората лития (LiBO•8H O(кр)) в водном растворе от температуры, полученная аппроксимацией экспериментальных данных [9,15,20], описывается аппроксимационным выражением:
![]()
которое справедливо в диапазоне температур 273,15 / 313,15 K.
Зависимость растворимости кристаллогидрата метабората лития (LiBO•2H O(кр)) в водном растворе от температуры, полученная аппроксимацией экспериментальных данных [9,15,20], описывается аппроксимационным выражением:
![]()
которое справедливо в диапазоне температур 313,15 / 423,15 K.
Зависимость растворимости кристаллогидрата метабората лития (LiBO•0,5H O(кр)) в водном растворе от температуры, полученная аппроксимацией экспериментальных данных [9], описывается аппроксимационным выражением:
![]()
которое справедливо в диапазоне температур 423,15 / 513,15 K.
Зависимость растворимости метабората лития (LiBO(кр)) в водном растворе от температуры , полученная аппроксимацией экспериментальных данных [9,21–23], описывается аппроксимационным выражением:
![]()
которое справедливо в диапазоне температур 513,15 / 633,15 K.
Растворимость, рассчитанная по уравнениям (10) – (13), измеряется в моль/кг растворителя (моляльность).
Полученные аппроксимирующие функции для четырех фазовых областей метаборатов лития представлены на рисунках 7 и 8.
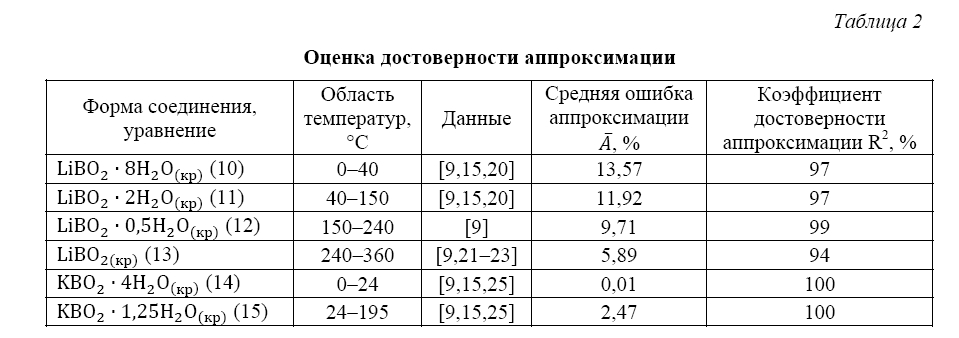
В таблице 2 приведены значения средней ошибки аппроксимации и коэффициента достоверности аппроксимации R2 для полученных уравнений регрессии, описывающих растворимость боратов лития в зависимости от температуры.
Из таблицы 2 следует, что для полученных аппроксимирующих функций в данной работе средняя ошибка аппроксимации не превышает 14 %, а коэффициент достоверности аппроксимации составляет не менее 94 %.
Ограниченность имеющихся в литературе экспериментальных данных (было найдено пять точек измерений растворимости метаборатов лития в области температур
от 150 до 250 °C) определяет необходимость получения дополнительных данных по растворимости боратов лития в воде и равновесным с ней насыщенном паре при повышенных температурах.
Равновесными твердыми фазами существования боратов калия в системе «борная кислота – гидроксид калия – вода» в диапазоне температур 0–350 °С являются: метабораты калия KBO•4H O(кр), KBO•1,25HO(кр), KBO•0,25HO(кр), KBO (кр), тетрабораты калия KBO•4H O(кр), KBO•2H O(кр), KBO•H O(кр), K BO(кр) и пентабораты калия KBO•4H O(кр), KBO•H O(кр), KBO•0,5HO(кр), KB O(кр) [9, 15, 25].
Равновесная форма существования твердых фаз боратов калия зависит от температуры.
При образовании метаборатов калия в системе «борная кислота – гидроксид калия – вода» кристаллогидрат KBO•4H O(кр) может существовать в области температур вплоть до температуры, равной 24 °С, выше которой возможно наличие кристаллогидрата KBO•1,25HO(кр) при температурах, не превышающих 195 °С [9]. Согласно [9] в области температур от 195 до 250 °С может присутствовать кристаллогидрат KBO•0,25HO(кр). Присутствие кристаллов метабората калия KBO(кр) при температуре свыше 250 °С вплоть до 300 °С установлено в работе [9]. По данным [9] в области температур выше 200 °С не наблюдается увеличение растворимости метаборатов калия водном растворе.
В работе [25] исследованы данные по растворимости метабората калия KBO •1,25HO(кр) в водном растворе в области температур от 250 до 400 °С. Приведенные в [25] экспериментальные результаты не подтвердили изменение знака температурного коэффициента растворимости метаборатов калия с положительного на отрицательный выше 250 °С. Согласно [25] растворимость метаборатов калия в водном растворе непрерывно возрастает при повышенных температурах.
При образовании тетраборатов калия в системе «борная кислота – гидроксид калия – вода» кристаллогидрат KBO•4H O(кр) может существовать в области температур вплоть до температуры, равной 145 °С, выше которой возможно наличие кристаллогидрата KBO•2H O(кр) при температурах, не превышающих 240 °С [9]. Присутствие кристаллов тетрабората калия KBO•H O(кр) при температурах выше 240 ° С вплоть до 300 °С установлено в работе [9].
В работе [25] исследованы данные по растворимости тетрабората калия K BO•2H O(кр) в водном растворе в области температур от 250 до 400 °С. Согласно [25] растворимость тетраборатов калия в водном растворе непрерывно возрастает при повышенных температурах.
При образовании пентаборатов калия в системе «борная кислота – гидроксид калия – вода» кристаллогидрат KBO•4H O(кр) может существовать в области температур вплоть до температуры, равной 165 °С, выше которой возможно наличие кристаллогидрата KBO•H O(кр). Данные о растворимости пентабората калия KB O•H O(кр) определены вплоть до температуры, равной 265 °С [9]. Отмечается в [9] возможность наличия твердой фазы пентабората калия KBO•0,5HO(кр) в области температур от 265 до 310 °С.
В работе [9] отмечается снижение растворимости боратов калия в водном растворе в области температур выше 260 °С. В работе [25] исследованы данные по растворимости пентабората калия KB O•H O(кр) в водном растворе в области температур от 250 до 400 °С. Приведенные в [25] экспериментальные результаты не подтвердили изменение знака температурного коэффициента растворимости пентаборатов калия с положительного на отрицательный выше 250 °С. Согласно [25] растворимость пентаборатов калия в водном растворе непрерывно возрастает при повышенных температурах.
Зависимость растворимости кристаллогидрата метабората калия (KBO•4H O(кр)) в водном растворе от температуры, полученная аппроксимацией экспериментальных данных [9,15,25], описывается аппроксимационным выражением:
![]()
которое справедливо в диапазоне температур 273,15 / 297,15 K.
Зависимость растворимости кристаллогидрата метабората калия (KBO•1,25HO(кр)) в водном растворе от температуры, полученная аппроксимацией экспериментальных данных [9,15,25], описывается аппроксимационным выражением:
![]()
которое справедливо в диапазоне температур 297,15 / 468,15 K.
Растворимость, рассчитанная по уравнениям (14) – (15), измеряется в моль/кг растворителя (моляльность).
Так как данные по существованию твердых фаз и растворимости метаборатов калия не согласуются в области высоких температур (свыше 195 °С) [9,25], то аппроксимация экспериментальных данных при температурах свыше 195 °С не была осуществлена.
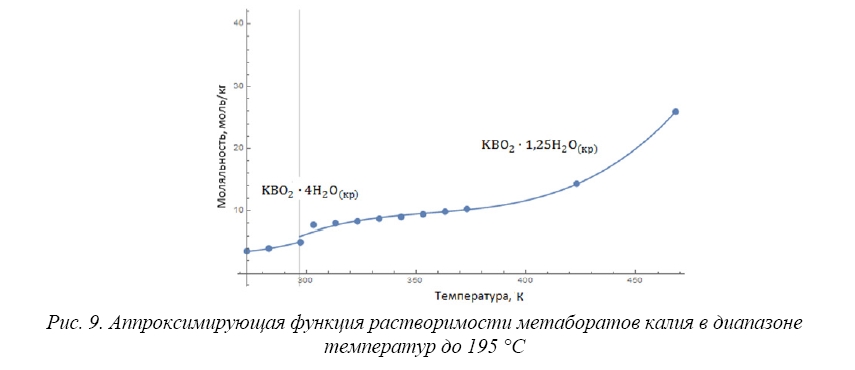
Рис. 9. Аппроксимирующая функция растворимости метаборатов калия в диапазоне температур до 195 °C
Полученные аппроксимирующие функции для двух фазовых областей метаборатов калия представлены на рисунке 9.
Для оценки погрешности аппроксимирующих функций, описывающих растворимость боратов калия в зависимости от температуры, были рассчитаны значения средней ошибки аппроксимации и коэффициента достоверности аппроксимации R2 (табл.2).
Из таблицы 2 следует, что для полученных аппроксимирующих функций в данной работе средняя ошибка аппроксимации не превышает 3 %, коэффициент достоверности аппроксимации равен 1, что обусловлено ограниченностью экспериментальных данных для метаборатов калия.
Таблица 2
Оценка достоверности аппроксимации
Заключение
В данной работе были систематизированы имеющиеся в литературе экспериментальные данные по растворимости соединений борной кислоты в диапазоне температур до 350 °С и получены аппроксимирующие выражения растворимости соединений борной кислоты в зависимости от температуры. В результате оценки погрешности аппроксимирующих функций получено, что средняя ошибка аппроксимации не превышает 14 %, а коэффициент достоверности аппроксимации составляет не менее 94 %.
Экспериментальные данные, имеющиеся в литературе, по растворимости боратов щелочных металлов в водном растворе при повышенных температурах ограничены и достаточно противоречивы, что обуславливает необходимость проведения дополнительных исследований.
Список литературы
- Шарафутдинов Р. Б., Харитонова Н. Л. Проблема оптимизации водно-химического режима I контура АЭС с ВВЭР в условиях увеличения длительности кампаний топливного цикла и повышения единичной мощности энергоблоков.// Теплоэнергетика. 2011. № 5. С. 21–27.
- Водно-химический режим первого контура для АЭС с ВВЭР-ТОИ / С.Н. Сусакин, С.И. Брыков, Н.В. Задонский, О.С. Быстрова // Водно-химический режим АЭС: 8-й МНТК ОАО Концерн «Росэнергоатом». Москва, 23–25.10.2012.
- R.E. Mesmer, C.F. Baes, Jr. and F.H. Sweeton // International Water Conference. 1971. РP. 55-65.
- Мартынова О.И., Харитонова Н.Л. Поведение растворов метаборатов лития в условиях глубокого упаривания. // Теплоэнергетика. 1990. №7. С. 53–56.
- R.E. Mesmer, C.F. Baes, F.H. Sweeton. Acidity measurements at elevated temperatures. VI. Boric acid equilibriums // Inorg.Chem. 1972. V. 11. P. 537–543.
- J. B. Farmer. In Advances in Inorganic Chemistry and Radiochemistry, H. J. Emeleus, A. G. Sharpe (Eds.), Academic Press, New York. 1982. PP. 187–237.
- F. C. Kracek, G. W. Morey, H. E. Merwin. The system, water—boron oxide // Am. J. Sci. 1938. V. 35. P.143-171.
- L. McCulloch. A Crystalline Boric Oxide // J. Am. Chem. Soc. 1937. V. 59. P. 2650-2652.
- Киргинцев А.И., Трушникова Л.Н., Лаврентьева В.Г. Растворимость неорганических веществ в воде: Справочник. Л.: Химия, 1972. 245 с.
- M. von Stackelberg, F. Quatram, J. Dressel. Die Fluchtigkeit der Borsaure mit Wasserdampf. Das System B2O3-Wasser // Z. Elektrochem. Ang. Phys. Chem. 1937. V. 43, P.14-28.
- A. Benrath. Uber die Loslichkeit von Salzen und Salzgemischen bei Temperaturen oberhalb von 100° // Z. Anorg Allg. Chem. 1942. V. 249. P. 245-250.
- W. C. Blasdale, C. M. Slansky. The Solubility Curves of Boric Acid and the Borates of Sodium // J. Am. Chem. Soc. 1939. V. 61. P. 917-920.
- N. P. Nies, R. W. Hulbert. Solubility Isotherms in the System Sodium Oxide-Boric OxideWater // J. Chem. Eng. Data. 1967. V.12. P. 303-313.
- R. Nasini, J. Ageno. Solnbilita e idrati dell’ acido borico // Z. Phys. Chem. 1910. V.69. P. 482-485.
- Smith R. A. Ullmann’s Encyclopedia of Chemical Technology, Boric Oxide, Boric Acid, and Borate, Wiley-VCH Verlag GmbH & Co. KGaA, 2012. V. 6, PP. 187–204.
- Perry’s Chemical Engineers’ Handbook (7th Edition), R. H. Perry and D. W. Green editors, McGraw-Hill, New York, 1997.
- Lange’s Handbook of Chemistry, 14th Edition, J. A. Dean, editor, McGraw-Hill, Inc., New York, 1992.
- Solubilities: Inorganic and Metal-Organic Compounds. W. F. Linke, editor, American Chemical Society, Washington, DC, 1958.
- P. Wang, J. J. Kosinski, M. M. Lencka, A. Anderko, R. D. Springer. Thermodynamic Modeling of Boric Acid and Selected Metal Borate Systems // Pure and Applied Chemistry. 2013. V. 85. P. 2117-2144.
- W. T. Reburn, W. A. Gale. The system lithium oxide-boric oxide-water // J. Phys. Chem. 1955. V. 59. P. 19-24.
- W. A. Byers, W. T. Lindsay, R. H. Kunig. Solubility of Lithium Monoborate in High Temperature Water // J. Solution Chem. 2000. V. 29. P. 541- 559.
- P. Cohen, Water Coolant Technology of Power Reactors. American Nuclear Society, LaGrange Park, IL. 1980. PP. 223–224.
- Z. M. Shapiro, ed., A Study of Chemical Control for PWR, Westinghouse Atomic Power Division (Bettis) Report WAPD–C(PC)–31, April 8, 1955, PP. 35A–39A.
- P. Cohen Water coolant technology of power reactors. N.Y.: Gordon and Breach Science Publishers, 1969.
- M. A. Urusova and V. M. Valyashko. Phase Equilibriums in Hydrothermal Systems Containing Sodium and Potassium Borates // Ross. Zh. Neorg. Khim. 1993. V. 38. P.662–667.

Если ты хочешь отличного отдыха, индивидуалки Анапа, секс и удовольствие, то это на prostitutkianapa.com. Да, вам совсем необязательно ехать куда-то, проститутки могут встретиться на вашей территории. Красивые индивидуалки Анапа, сладкие и ухоженные, они такие заботливые и стройные, что у тебя будет сегодня классный секс. Окунись в удовольствие.
 onetwoclick.ru
onetwoclick.ru